Mobilisatie
Uitgangsvraag
Wanneer en hoe dienen patiënten met sepsis te worden gemobiliseerd?
De uitgangsvraag omvat de volgende deelvragen:
- Wanneer is het veilig voor patiënten met sepsis om te starten met (vroege) mobilisatie en activatie?
- Wat zijn de meest effectieve interventies met de daarbij behorende FITT-criteria (frequentie, intensiteit, therapie, tijd) voor mobiliseren en training van patiënten met sepsis?
Aanbeveling
Streef ernaar bij patiënten met sepsis op een intensive care zo vroeg mogelijk te beginnen met mobilisatie en activatie, met inachtneming van de risico’s voor de individuele patiënt.
Start bij patiënten met sepsis op een verpleegafdeling zo vroeg mogelijk met mobilisatie en activatie, tenzij anders aangegeven door de behandelend arts.
Streef bij patiënten met sepsis naar de meest actieve vorm van mobilisatie en activatie om een optimale trainingsprikkel te geven, met inachtneming van de risico’s voor de individuele patiënt.
Overwegingen
Voor- en nadelen van de interventie en de kwaliteit van het bewijs
Het vroeg starten met mobilisatie en/of activatie van patiënten met sepsis kan mogelijk fysieke achteruitgang voorkomen. Echter wanneer en hoe patiënten met sepsis gemobiliseerd dienen te worden was tot op heden nog onbekend. Er is een literatuuronderzoek verricht naar: 1) de ongunstige effecten van vroeg starten met mobilisatie en activatie ten opzichte van laat starten of standaard zorg bij volwassen patiënten met sepsis; en 2) de (on)gunstige effecten van mobilisatie, passieve therapie of actieve therapie ten opzichte van elkaar en ten opzichte van andere vormen van mobilisatie en activatie bij volwassen patiënten met sepsis.
Op basis van de geselecteerde literatuur blijft het onduidelijk of vroege mobilisatie het risico op mortaliteit verhoogt bij volwassen patiënten met sepsis ten opzichte van standaard zorg. De twee studies zijn inconsistent wat betreft de risico’s op mortaliteit en daarom is het niet mogelijk hier een conclusie uit te trekken. Daarnaast is de bewijskracht voor deze uitkomstmaat zeer laag omdat de studie gebaseerd is op een zeer gering aantal patiënten. Hier ligt een kennislacune. In IC-patiënten zijn de voor- en nadelen van mobilisatie en/ of activatie beter bekend. In een systematische review van 14 RCT’s is beschreven dat actieve mobilisatie en revalidatie op de IC geen impact hebben op mortaliteit bij IC-patiënten, wanneer veiligheid consensus richtlijnen en teambenadering gevolgd worden (Tipping, 2017; Okada 2019). Hierbij worden mobilisatie en activatie beschreven als vormen van actieve handelingen. Dit kunnen actieve interventies zijn die in bed uitgevoerd kunnen worden: actieve oefentherapie op bed, actief fietsen op bed, transfers van lig naar zit in bed, zitten op rand van bed; maar ook alle actieve interventies uit het bed: transfer van bed naar stoel, sta-transfertraining, statafel, en lopen. Al deze handelingen worden uitgevoerd door een lid van het IC team en vinden daadwerkelijk op de IC plaats. Studies gericht op passieve therapie zoals passief oefenen op bed, passief fietsen en elektrostimulatie en studies die in een langdurig beademingscentrum of revalidatie setting plaatsvonden werden niet meegenomen in de systematische review (Tipping, 2017).
Op basis van de literatuur lijkt er geen risico te zijn op het ontstaan van bijwerkingen gerelateerd aan het vroeg starten met mobilisatie bij patiënten met sepsis. In een gerandomiseerde pilotstudie werden geen bijwerkingen gerapporteerd. De bewijskracht van de literatuur is echter laag omdat de studie is gebaseerd op een zeer gering aantal patiënten. Dit wil zeggen dat het mogelijk is dat er op basis van vervolgonderzoek andere conclusies getrokken kunnen worden. Bij IC-patiënten zijn de nadelen van het vroegtijdig starten met mobilisatie en activatie beter bekend. In de systematische reviews van Menges (2021) en Tipping (2017) werd beschreven dat het aantal bijwerkingen bij actieve mobilisatie en activatie verhoogd is. Bijwerkingen die optraden waren bijvoorbeeld desaturatie < 80%, verlaagde hartfrequentie, hypo-of hypertensie en het verwijderen van tube of belangrijke lijnen. Van studies met passieve vormen van interventies is bekend dat deze een laag aantal ongewenste bijwerkingen hebben (Maheswaran, 2020). Echter ook bij deze interventies zijn wel bijwerkingen gevonden, maar deze zijn meer gericht op dislocatie van lijnen en tube (Fossat, 2018). Voor de behandeling van IC-patiënten is het wenselijk om eventuele bijwerkingen te beperken, vandaar dat het wenselijk is om deze patiënten te laten starten met vroege mobilisatie en activatie, wanneer zij voldoen aan de specifieke veiligheidsvoorwaarden (Tabel 11.3) (Sommers, 2015). Deze specifieke veiligheidsvoorwaarden gelden als (relatieve) contra-indicaties voor het mobiliseren uit bed en actieve fysiotherapie van een IC-patiënt. Voor het mobiliseren uit bed en het activeren van een patiënt die voldoet aan een van de criteria dient vooraf overleg plaats te vinden met de IC-verpleegkundige en/of intensivist. Deze veiligheidscriteria zijn op basis van consensus van 14 Nederlandse ziekenhuizen opgesteld en middels post-HBO scholing geïmplementeerd in de Nederlandse ziekenhuizen. Voor een sepsispatiënt op de verpleegafdeling zijn geen veiligheidsvoorwaarden beschreven, hierbij wordt ervan uit gegaan dat deze hemodynamisch stabiel is en dat er in principe geen reden is om niet te mobiliseren, tenzij de behandelend arts aangeeft dat het niet mag.
Tabel 11.3 Relatieve contra-indicaties voor het mobiliseren uit bed en actieve fysiotherapie bij een IC-patiënt
|
Hartslag |
|
|
Bloeddruk |
|
|
Saturatie |
|
|
Beademingsparameters |
|
|
Ademhalingsfrequentie |
|
|
Bewustzijnsniveau van patiënt |
|
|
Dosis inotropica
|
|
|
Temperatuur
|
|
|
Overige
|
|
Bron: Sommers (2015)
Vanwege het ontbreken van literatuur die de cruciale uitkomstmaat functionaliteit/activiteit rapporteert kon er geen conclusie worden getrokken met betrekking tot het type interventie dat voor betere resultaten zorgt voor patiënten met sepsis. In één RCT werd geen klinisch relevant verschil gevonden tussen de IC-opnameduur bij patiënten waarbij passieve en actieve oefentherapie in combinatie met passief of actief fietsen in of uit bed werd toegepast, ten opzichte van patiënten waarbij alleen passieve en actieve oefentherapie op bed werd toegepast. Echter de bewijskracht van de literatuur is zeer laag omdat het gebaseerd is op een studie met een hoog risico op bias en omdat de studie gebaseerd is op een zeer gering aantal patiënten. Ook hier ligt dus een kennislacune. Bij IC-patiënten zijn de (on)gunstige effecten van mobilisatie, passieve therapie of actieve therapie ten opzichte van elkaar en ten opzichte van andere vormen van mobilisatie en activatie niet eenduidig beschreven. Hierdoor is er geen eenduidige conclusies te trekken ten aanzien van de meest effectieve interventie en de daarbij behorende FITT-criteria (Eggman, 2018; Machado, 2017; Mc William, 2018; Medrinal, 2018; Reid, 2018; Wright, 2017). Wel zien we in afzonderlijke studies dat vroege mobilisatie en activatie positieve effecten hebben om de fysieke uitkomsten van IC-patiënten te verbeteren (Castro- Avila, 2015; Reid, 2018) en de verblijfsduur te verkorten (Needham, 2010). Tevens wordt er vanuit kwalitatief onderzoek door overlevers van de IC aangegeven dat revalidatie een belangrijk rol speelt in het herijken van toekomstig functioneren (Corner 2019). Echter door de verschillen in dagelijkse zorg, het gebruik van verschillende FITT-criteria en het gebruik van verschillende inclusiecriteria blijven de totale conclusies moeilijk te trekken (Hodgson, 2016). Uitgaande van de enorme impact van sepsis, inactiviteit en bedrust op het musculoskeletale systeem, inclusief diafragma zwakte binnen 24 uur en extreem spiermassa verlies binnen 1 week (Friedrich, 2015; Parry, 2015; Puthucheary, 2013; Puthucheary, 2018), is het van belang om vroegtijdige mobilisatie en activatie te starten om deze negatieve effecten te beperken. Om overbelasting te voorkomen en veiligheid te waarborgen is het van belang dat bij iedere behandeling bij patiënten op de IC de veiligheidscriteria in acht genomen worden (tabel 11.3). Tevens wordt er aanbevolen om het aantal herhalingen van de oefeningen, de duur van de behandeling en de daarbij behorende intensiteit te noteren en tevens de mate van vermoeidheid indien mogelijk, middels de Borg score (Balady, 2010) uit te vragen. Op deze wijze kan de mate van belasting vastgesteld worden en overbelasting worden voorkomen (Sommers, 2015).
De totale bewijskracht voor de cruciale uitkomstmaten van beide deelvragen is zeer laag. Er is meer onderzoek nodig bij patiënten met sepsis, om uitsluitsel te krijgen wanneer en hoe patiënten met sepsis gemobiliseerd en geactiveerd dienen te worden. Echter uitgaande van de negatieve effecten van sepsis, inactiviteit en bedrust en verkorting van de verblijfsduur door tijdige mobilisatie bij ernstig zieke patiënten, wordt er aanbevolen dat het starten van de mobilisatie en revalidatie zo vroegtijdig mogelijk dient plaatst te vinden. Dit geldt voor patiënten op de IC als patiënten op de verpleegafdeling. Op het gebied van de juiste interventie met de daarbij behorende optimale FITT criteria kunnen we geen specifieke aanbeveling geven, deze vragen dienen nog verder onderzocht te worden.
Waarden en voorkeuren van patiënten (en eventueel hun verzorgers/familie)
De voorkeur van de patiënt voor deze interventies is niet onderzocht en onbekend. Vroege mobilisatie en activatie zijn veelbelovende interventies om de negatieve gevolgen van inactiviteit, bedrust en de ernstige ziekte op het fysiek functioneren te beperken, waardoor de fysieke uitkomsten ((adem)-spierzwakte, verminderde longcapaciteit, inspanningstolerantie en ADL (algemene dagelijkse levensverrichtingen) zelfstandigheid) bij ontslag uit het ziekenhuis geoptimaliseerd kunnen worden. Ondanks de hoge mate van inspanning die de laag belastbare en ernstig zieke patiënten dienen te ondergaan bij de mobilisatie en activatie, wordt deze toch door patiënten op de IC als waardevol ervaren bij het opstellen van de korte termijn doelen en het doorlopen van de verschillende mijlpalen (Corner, 2019). Door het geven van vroegtijdige informatie over het revalidatieproces, met de daarbij behorende mijlpalen, geeft dit inzicht voor de patiënt waardoor het verwachtingspatroon richting ontslag en behalen van mijlpalen aangepast kan worden. Patiënten ervaren de mobilisatie/ activatie als hoopvol. Het geeft hun structuur in de dag, de intrinsieke motivatie wordt aangesproken en met het verbeteren van de functionaliteit zien ze ook weer het vertrouwen in eigen lichaam en de eigen regie terugkeren, wat tevredenheid over de behandeling bewerkstelligt.
Kosten (middelenbeslag)
Het vroegtijdig starten van mobilisatie en activatie zorgt voor een toename in aantal Fte’s (met name fysiotherapie), wat extra financiële kosten met zich meebrengt. Deze kosten winnen zich echter niet altijd direct terug op het moment dat de interventie plaatsvindt, maar kunnen bij IC-patiënten wel voor verkorting van ziekenhuisverblijfsduur en een verbeterd fysiek functioneren bij sepsis- en IC-patiënten bij ontslag zorgen (Ahn, 2018; Kayambu, 2015; Needham, 2010). Bij IC-patiënten zijn de lange-termijn-effecten en zorgverbruik beschreven (van Beusekom, 2019a; van Beusekom, 2019b; Haines, 2018; van der Schaaf). Echter, interventie studies gericht op kostenreductie voor de lange termijn zijn tot op heden nog niet gepubliceerd. Het op te zetten REACH netwerk: “Rehabilitation After Critical Illness and Hospital discharge” binnen de ZonMw subsidieronde Juiste Zorg op de Juiste Plek heeft naast het ontwikkelen van een optimaal revalidatieprogramma, ook kostenreductie als een primaire uitkomstfactor benoemd.
Aanvaardbaarheid, haalbaarheid en implementatie
Vanwege het ontbreken van studies bij patiënten met sepsis ten aanzien van de implementatie van vroege mobilisatie en activatie kan er alleen informatie gegeven worden vanuit de subgroep IC-patiënten. Bij IC-patiënten is vroeg mobilisatie en activatie haalbaar, wanneer veiligheid, consensus richtlijnen en teambenadering gevolgd worden (Reid, 2018). Belemmerende factoren voor implementatie van vroeg mobilisatie en activatie zijn onder andere sedatie, hemodynamische instabiliteit, onvoldoende kennis van veiligheidscriteria, aanwezigheid van beademing en onvoldoende personeel (Capell, 2018; Nydahl, 2014; Team study investigators, 2015; Wahab, 2016). In Nederland vindt de implementatie van vroege mobilisatie en activatie op het gebied van fysiotherapie, plaats binnen de post HBO scholing voor fysiotherapeuten op de IC. 80% van de ziekenhuizen gebruiken de beschreven veiligheidscriteria voor het bepalen van het startmoment van mobilisatie en activatie en 71% is in staat is om de dagelijkse zorg te leveren, waarbij het tekort aan personeel hierin de grootste rol speelt. Naast de scholing voor fysiotherapeuten op de IC, is het van belang dat ook het medische personeel geschoold wordt op het gebied van kennis en vaardigheden t.a.v. mobilisatie en activatie. De fysiotherapeut van desbetreffende afdeling kan hierin een belangrijke sleutelrol in spelen.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventies
Vroegtijdige mobilisatie en activatie voor ernstig zieke patiënten wordt aanbevolen ter preventie van fysieke achteruitgang. Bij IC-patiënten is beschreven dat vroege mobilisatie en activatie op de IC geen impact heeft op mortaliteit bij IC-patiënten, wanneer veiligheid, consensusrichtlijnen en teambenadering gevolgd worden. Het is van belang om eventuele bijwerkingen van vroege mobilisatie en activatie te voorkomen of te beperken.
Rationale van de aanbeveling: weging van argumenten voor en tegen de interventie
Om het fysiek functioneren van patiënten met sepsis te verbeteren dient een optimale trainingsprikkel aangeboden te worden. Aangezien we hier te maken hebben met een laag belastbare en soms medisch instabiele patiënten groep is het van belang dat de trainingsprikkel bereikt dient te worden, maar dat er tegelijkertijd ook rekening wordt gehouden met de veiligheid van de interventie en dient de fysieke overbelasting vermeden te worden. Bij IC-patiënten wordt er aanbevolen om zo snel mogelijk, afhankelijk van de hemodynamische stabiliteit en belastbaarheid van de patiënt te starten met mobilisatie en activatie. Passieve interventies kunnen al zeer vroeg in het proces plaatsvinden, waarbij zo snel mogelijk overgegaan dient te worden naar actievere vormen van mobilisatie en activatie, met inachtneming van de veiligheidscriteria en de mate van ervaren inspanning van de patiënt.
Onderbouwing
Achtergrond
We zien dat patiënten met sepsis die onderhevig zijn aan inflammatoire cytokines en inactiviteit op basis van het ernstig ziek zijn, ten opzichte van algemeen geconditioneerde ziekenhuispatiënten, te maken hebben met een versneld verlies van spiermassa (perifeer en ademspieren/diafragma) en conditie, wat leidt tot verlengde beademingsduur bij beademde patiënten en beperkingen in het fysiek functioneren (Callahan, 2009; Dress, 2017; Friedrich, 2015; Hofhuis, 2008).
Vroegtijdige mobilisatie en activatie voor ernstig zieke patiënten wordt aanbevolen ter preventie van fysieke achteruitgang. Het moment om veilig te starten met mobilisatie en activatie is echter niet beschreven voor patiënten met sepsis. Om beperkingen van het fysiek functioneren te minimaliseren dient men idealiter een optimale trainingsprikkel toe. Hierbij dient de trainingsbelasting voldoende te zijn, maar dient tegelijkertijd de oefensessie veilig te zijn en moet fysiologische overbelasting worden vermeden. Kennis over veilige en effectieve trainingsinterventies bij patiënten met sepsis ontbreekt nog.
Conclusies
Deelvraag 1: Timing
|
Zeer laag GRADE |
Het is onduidelijk of de mortaliteit toeneemt bij het toepassen van vroege mobilisatie ten opzichte van standaardzorg bij patiënten met sepsis.
Bronnen: (Ahn, 2018; Kayambu, 2015) |
|
Laag GRADE |
Mogelijk is er geen verhoogd risico op bijwerkingen bij het toepassen van vroege mobilisatie ten opzichte van standaardzorg bij patiënten met sepsis.
Bronnen: (Kayambu, 2015) |
Deelvraag 2: Type interventie
|
- GRADE |
Vanwege het ontbreken van studies waarin de functionaliteit/activiteit werd gerapporteerd bij patiënten met sepsis was het niet mogelijk een conclusie te trekken voor deze uitkomstmaat. |
|
Zeer laag GRADE |
Het is onduidelijk of de intensive-careverblijfsduur afneemt bij het toepassen van passieve en actieve oefentherapie in combinatie met passief of actief fietsen in of uit bed ten opzichte van alleen passieve en actieve oefentherapie van de extremiteiten op bed bij patiënten met sepsis.
Bronnen: (Hickmann, 2018) |
|
- GRADE |
Vanwege het ontbreken van studies waarin de ziekenhuisverblijfsduur werd gerapporteerd bij patiënten met sepsis was het niet mogelijk een conclusie te trekken voor deze uitkomstmaat. |
|
Zeer laag GRADE |
Het is onduidelijk of het aantal bijwerkingen toeneemt bij het toepassen van passieve en actieve oefentherapie in combinatie met passief of actief fietsen in en uit bed ten opzichte van alleen passieve en actieve oefentherapie en bij het toepassen van elektrospierstimulatie van quadriceps en biceps ten opzichte van actieve/passieve oefentherapie bij patiënten met sepsis.
Bronnen: (Hickmann, 2018; Shen, 2017) |
|
Zeer laag GRADE |
Het is onduidelijk of de duur van de beademing afneemt bij het toepassen van passieve en actieve oefentherapie in combinatie met passief of actief fietsen in of uit bed ten opzichte van alleen passieve en actieve oefentherapie van de extremiteiten op bed bij patiënten met sepsis.
Bronnen: (Hickmann, 2018) |
|
- GRADE |
Vanwege het ontbreken van kwantitatieve gegevens over spierkracht bij patiënten met sepsis was het niet mogelijk een conclusie te trekken voor deze uitkomstmaat. |
Samenvatting literatuur
Deelvraag 1: Timing
De RCT van Ahn (2018) vergeleek vroege mobilisatie en activatie met standaard zorg op het functioneel herstel bij volwassen patiënten met ernstige sepsis. Volwassen patiënten (> 20 jaar) die de spoedeisende hulp bezochten met ernstige sepsis (bewezen of vermoedelijke infectie met twee of meer criteria voor systemische inflammatie en daarbij orgaan falen of hypotensie werden gerandomiseerd voor het starten met vroege mobilisatie en activatie of standaard zorg. Exclusiecriteria waren: zwangerschap, infectie van het centrale zenuwstelsel, onderliggende cognitieve of functionele beperkingen waardoor patiënten niet zelfstandig zijn, verwacht overlijden binnen 24 uur, contra-indicatie voor mobilisatie en activatie en risico voor het verslechteren van de conditie door mobilisatie en activatie. In totaal ontvingen 21 patiënten de interventie vroege mobilisatie en activatie en 19 patiënten standaardzorg. De interventie bestond uit één tot tweemaal daagse mobilisatie of activatie door middel van gerichte oefeningen (passieve en actieve oefentherapie gericht op het verbeteren van de beweeglijkheid van de gewrichten, NMES, zitten, staan, lopen en andere vormen van mobilisatie afhankelijk van de conditie van de patiënt) voor ten minste 1 uur samen met een fysiotherapeut vanaf het moment van randomiseren tot aan ontslag uit het ziekenhuis. De controlegroep ontving standaard zorg (passieve en actieve oefentherapie op bed gericht op het verbeteren van de beweeglijkheid van de gewrichten en zitten in bed). De follow-up bedroeg van 6 maanden. Deze studie heeft een laag risico op bias.
De RCT van Kayambu (2015) vergeleek het effect van vroege mobilisatie en activatie door middel van fysiotherapie ten opzichte van standaard zorg bij volwassen patiënten met sepsis. Volwassen patiënten (≥ 18 jaar) opgenomen op de IC met mechanische ventilatie voor ≥48 uur met een diagnose sepsis, ernstige sepsis of septische shock. Exclusiecriteria waren: hoofdwonden, brandwonden, letsel aan de wervelkolom, meerdere botbreuken in de onderste ledematen, patiënten met septische shock die niet op de maximale behandeling reageerden, stervend of verwacht overlijden binnen 48 uur. In totaal ontvingen 26 patiënten de interventie vroege mobilisatie en activatie door middel van fysiotherapie en 24 patiënten standaard zorg. De interventie bedroeg een één tot tweemaal daags individueel mobilisatie en activatie programma van 30 minuten voorgeschreven door een IC onderzoeksfysiotherapeut. Dit programma kon bestaan uit NMES, passieve en actieve oefentherapie gericht op het verbeteren van de beweeglijkheid van de gewrichten, zitten, transfers in en uit bed, lopen en andere vormen van mobilisatie afhankelijk van de conditie van de patiënt. De therapie werd gestart binnen 48 uur na sepsis diagnose en duurde tot aan het ontslag van de IC. De controlegroep ontving standaard zorg (fysiotherapie van een IC fysiotherapeut). De totale follow-up duur was 90 dagen. Deze studie heeft een laag risico op bias.
Deelvraag 2: Type interventie
De RCT van Hickmann (2018) vergeleek het effect van twee soorten vroege fysiotherapie bij volwassen patiënten met sepsis. Volwassen patiënten met een septische shock werden geïncludeerd binnen 72 uur na IC-opname. Exclusiecriteria waren: pre-existerende cognitieve beperkingen, ondervoeding of cachexie, niet zelfstandig kunnen lopen, beenamputatie, botbreuken, het krijgen van chemotherapie, chronische corticosteroïde behandeling, cardiorespiratoir arrest, verwachte IC-opname van minder dan 7 dagen, stopzetten van de therapie en dreigend overlijden. In totaal werden 19 patiënten geïncludeerd, 9 in de interventiegroep en 10 in de controlegroep. De interventie bestond uit tweemaal daagse fysiotherapie bestaande uit passieve en actieve oefentherapie van de extremiteiten en passief of actief fietsen in stoel of bed gedurende zeven dagen. De controlegroep ontving eens per dag passieve en actieve oefentherapie van de extremiteiten. De fysiotherapie werd in beide gevallen gestart in de eerste 72 uur na diagnose van septische shock. De follow-up bedroeg 28 dagen. Aan het einde van de follow-up konden alle patiënten uit de interventiegroep (100%) en het merendeel van de patiënten uit de controlegroep (83%) verplaatst worden naar een stoel en lopen onder begeleiding van een fysiotherapeut. Deze studie heeft een hoog risico op bias, vanwege de subjectieve uitkomstmaten, een onbekende randomisatieprocedure, het ontbreken van blindering van de patiënten en zorgverleners, en vanwege een verschil in startmoment van de eerste mobilisatie sessie.
De RCT van Shen (2017) vergeleek het effect van elektrospierstimulatie op de quadriceps en biceps spieren ten opzichte van actieve of passieve oefentherapie van de extremiteiten bij volwassen patiënten met ernstige sepsis en acuut falen van de ademhaling. Volwassen patiënten (20-90 jaar) opgenomen met ernstige sepsis waarbij mechanische ventilatie (> 72 uur) werd toegepast werden geïncludeerd. Exclusiecriteria waren: huidafwijking of infectie rondom de dijen, acuut myocardinfarct in de eerste week, levensbedreigende hartritmestoornissen, zwangerschap, verwacht overlijden binnen een maand, ernstige encefalopathie met coma zonder spontane ademhaling, ongecontroleerde epilepsie, patiënt was volledig bij bewustzijn en in staat om actieve oefeningen te voltooien, infectieziekte (tuberculose of griep), ademhalingsstoornissen waarbij neuromusculaire blokkers gegeven werden en patiënten aan de hart-long machine. In totaal ontvingen 18 patiënten met sepsis de interventie elektrospierstimulatie en 7 patiënten met sepsis actieve of passieve oefentherapie van de extremiteiten zonder elektrostimulatie (controlegroep). De follow-up duur was tot aan ontslag uit het ziekenhuis. Deze studie heeft een hoog risico op bias, vanwege de subjectieve uitkomstmaten, een onbekende randomisatieprocedure en het ontbreken van blindering van patiënten, zorgverleners en uitkomstbeoordelaars.
Resultaten
Deelvraag 1: Timing
Mortaliteit
In beide RCT’s werd de uitkomstmaat mortaliteit beschreven (Ahn, 2018; Kayambu, 2015). In figuur 2 zijn de resultaten (relatief risico (RR) met 95% betrouwbaarheidsinterval (BI)) van deze twee studies weergegeven. De follow-up periode van de uitkomstmaat mortaliteit was verschillend binnen deze twee RCT’s en daarom zijn de resultaten van deze studies niet gepooled. Gedurende de studie van Kayambu (2015) overleden 3 van de 26 patiënten in de interventiegroep (11,5%), ten opzichte van 1 van de 24 patiënten (4,2%) uit de controlegroep (RR 2,77; 95% BI 0,31 tot 24,85) tijdens opname in het ziekenhuis. Ook na 90 dagen was het risico op overlijden nog steeds hoger in de interventiegroep (RR 3,69; 95% BI 0,87 tot 15,69). Beide gerapporteerde verschillen zijn klinisch relevant in het voordeel van de controlegroep. Gedurende de studie van Ahn (2018) overleden 3 van de 21 patiënten uit de interventiegroep (14,3%), ten opzichte van 4 van de 19 patiënten uit de controlegroep (21,1%) (RR 0,68; 95% BI 0,17 tot 2,65) na maximale follow-up van 6 maanden. Het gerapporteerde verschil is klinisch relevant in het voordeel van de interventie.
Figuur 2 Mortaliteit bij patiënten met sepsis met interventie vroege mobilisatie ten opzichte van standaard zorg
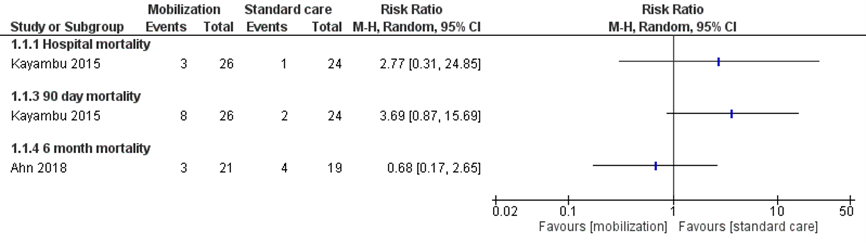 CI: betrouwbaarheidsinterval
CI: betrouwbaarheidsinterval
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat mortaliteit is gebaseerd op gerandomiseerde trials en start daarom op hoog. De bewijskracht is met 1 niveau verlaagd gezien de tegenstrijdige resultaten (inconsistentie). Daarnaast is de bewijskracht met nog twee niveaus verlaagd vanwege de overschrijding van het betrouwbaarheidsinterval met de grenzen voor klinische besluitvorming en vanwege het zeer gering aantal patiënten (imprecisie). De bewijskracht van de literatuur komt hiermee uit op zeer laag.
Bijwerkingen
In de RCT van Kayambu (2015) werd in geen enkele patiënt in de interventiegroep een bijwerking gerapporteerd tijdens de oefensessies. Er is dus geen toename in RR bij vroege fysiotherapie ten opzichte van standaard zorg. In de RCT van Ahn (2018) werd de uitkomstmaat bijwerkingen niet gerapporteerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bijwerkingen is gebaseerd op een gerandomiseerde trial en start daarom op hoog. De bewijskracht is met twee niveaus verlaagd vanwege het zeer geringe aantal patiënten (imprecisie). De bewijskracht komt hiermee uit op laag.
Deelvraag 2: Type interventie
Functionaliteit/activiteit
De uitkomstmaat functionaliteit/activiteit werd niet gerapporteerd in de geselecteerde literatuur.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat functionaliteit/activiteit is niet te beoordelen, omdat dit niet is onderzocht.
Intensive-careverblijfsduur
In de RCT van Hickmann (2018) bedroeg de mediane IC-verblijfsduur 6,7 dagen (interkwartielrange (IQR) 4,8 tot 21,0 dagen) in de interventiegroep, ten opzichte van 7,3 (IQR 6,8 tot 15,3 dagen) dagen in de controlegroep. Dit betekent dat patiënten die de interventie manuele mobilisatie met fietstherapie ontvingen 0,6 dagen korter opgenomen liggen op de IC ten opzichte van patiënten die alleen passieve en actieve oefentherapie van de extremiteiten ontvingen. Het gerapporteerde verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat IC-verblijfsduur is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de studieopzet (risk of bias) omdat blindering van patiënten en zorgverleners ontbrak. Daarnaast is er met twee niveaus verlaagd vanwege een zeer gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Ziekenhuisverblijfsduur
De uitkomstmaat ziekenhuisverblijfsduur werd niet gerapporteerd in de geselecteerde literatuur.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ziekenhuisverblijfsduur is niet te beoordelen, omdat dit niet is beschreven.
Bijwerkingen
In beide RCT’s werden bijwerkingen in de interventiegroep beschreven (Hickmann, 2018; Shen, 2017). In de RCT van Hickmann (2018) werd tijdens één van de 69 sessies (1,4%) een ‘safety event’ gerapporteerd, namelijk een reversibele hypotensie. Dit komt overeen met een bijwerking in 1 van de 9 patiënten (11,1%) in de interventiegroep waarbij actieve en passieve oefentherapie met fietstherapie in of uit bed werd toegepast. In de controlegroep waarbij alleen passieve en actieve oefentherapie op bed werd toegepast werden geen ‘safety events’ gerapporteerd. Dit betekent dat er een klinisch relevant verhoogd risico is op bijwerkingen bij toepassing van de interventie groep. In de RCT van Shen (2017) werden in geen van de patiënten in de interventiegroep schade aan de huid, hartritmestoornissen of andere bijwerkingen gerapporteerd. Daarnaast werden er geen bijwerkingen in de controlegroep gerapporteerd.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat bijwerkingen is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de studieopzet (risk of bias) omdat blindering van patiënten en zorgverleners ontbrak, verschillende therapieën met elkaar worden vergeleken en daarnaast was het startmoment voor vroege mobilisatie verschillend voor de interventie en controlegroep in de studie van Hickmann (2018). Daarnaast is er met twee niveaus verlaagd vanwege een zeer gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Duur van beademing (bij beademde patiënten)
In de RCT van Hickmann (2018) bedroeg de mediane duur van beademing 5,5 dagen (interkwartielrange (IQR) 1,8 tot 16,9 dagen) in de interventiegroep, ten opzichte van 4,7 (IQR 1,9 tot 10,8 dagen) dagen in de controlegroep. Dit betekent dat patiënten die de interventie ontvingen 0,8 dagen langer mechanisch werden beademd ten opzichte van patiënten die alleen manuele mobilisatie ontvingen. Het gerapporteerde verschil is niet klinisch relevant.
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat duur van beademing is gebaseerd op RCT’s en start daarom op hoog. Er is afgewaardeerd vanwege beperkingen in de studieopzet (risk of bias) omdat het startmoment voor vroege mobilisatie verschillend voor de interventie en controlegroep. Daarnaast is er met twee niveaus verlaagd vanwege een zeer gering aantal patiënten/events (imprecisie). De bewijskracht komt hiermee uit op zeer laag.
Spierkracht
In de studie van Hickmann (2018) werd de spierkracht gemeten door een geblindeerde fysiotherapeut door middel van een ‘MRC-score’ op dag 1 en dag 7. Er waren slechts resultaten beschikbaar van vijf patiënten (3 uit de controlegroep en 2 uit de interventiegroep) omdat patiënten niet bij bewustzijn waren, niet mee wilden werken of omdat er geen geblindeerde fysiotherapeut beschikbaar was. Omdat dit te weinig samples zijn om een goede vergelijking te maken, rapporteerde de studie geen verschillen tussen de patiënten waarbij de interventie werd toegepast ten opzichte van de controlegroep.
In de studie van Shen (2017) werd de spierkracht gemeten door middel van de ‘handgrip dynamometer’. Echter 17 van de 25 patiënten waren niet in staat om deze test uit te voeren in verband met te weinig kracht, mate van sedatie en/of onvoldoende coöperatief waren. Acht patiënten hebben de test wel uitgevoerd, echter er werd geen vergelijking gemaakt tussen patiënten waarbij de interventie elektrospierstimulatie werd toegepast ten opzichte van patiënten waarbij actieve of passieve oefentherapie zonder elektrostimulatie werd toegepast (controlegroep).
Bewijskracht van de literatuur
De bewijskracht voor de uitkomstmaat ‘spierkracht’ is niet te beoordelen, omdat dit onvoldoende is beschreven.
Zoeken en selecteren
Om de uitgangsvraag te kunnen beantwoorden is er een systematische literatuuranalyse verricht naar de volgende zoekvragen:
Deelvraag 1: Timing
Wat zijn de ongunstige effecten van vroeg starten met mobilisatie/training van volwassen patiënten met sepsis ten opzichte van laat starten of standaardzorg?
P: volwassen patiënten met sepsis;
I: vroege start van mobilisatie en activatie (passieve oefentherapie/actieve oefentherapie);
C: late start of standaardzorg;
O: mortaliteit en bijwerkingen.
Deelvraag 2: Type interventie
Wat zijn de (on)gunstige effecten van mobilisatie, passieve therapie of actieve therapie ten opzichte van elkaar en ten opzichte van andere vormen van mobilisatie en activatie?
P: volwassen patiënten met sepsis;
I: mobilisatie/passieve therapie/actieve therapie;
C: vergelijking van interventies onder I;
O: functionaliteit/activiteit, intensive-careverblijfsduur, ziekenhuisverblijfsduur, bijwerkingen, duur van beademing (bij beademde patiënten) en spierkracht.
Relevante uitkomstmaten
De werkgroep achtte bijwerkingen en mortaliteit voor de besluitvorming cruciale uitkomstmaten voor deelvraag 1. Voor deelvraag 2 achtte de werkgroep functionaliteit/activiteit een voor de besluitvorming cruciale uitkomstmaat; intensive-careverblijfsduur, ziekenhuisverblijfsduur, bijwerkingen, duur van beademing en spierkracht werden gedefinieerd als belangrijke uitkomstmaten.
De werkgroep definieerde de uitkomstmaten als volgt:
- Functionaliteit/activiteit: (Johns Hopkins highest level of mobility score (JH-HLM), 6-minute walk test (6MWT) en de Morton Mobility Index (DEMMI).
- Spierkracht: Medical Research Council (MRC) sum score en hand-held dynamometer (HHD).
De overige uitkomstmaten werden niet a priori door de werkgroep gedefinieerd; hiervoor werden de in de literatuur gebruikte definities gehanteerd. De werkgroep volgde de in de literatuur gebruikte definities van vroege en late start van behandeling.
Binnen de literatuur worden de termen “mobilisatie”, “activatie” en “revalidatie” vaak door elkaar heen gebruikt. Om eenduidigheid te creëren hebben we onderstaande definities overgenomen:
Binnen de literatuur over de intensive care (IC) wordt met de term mobilisatie vaak het proces van verplaatsen uit bed verstaan. Internationale definities ten aanzien van de verschillende vormen van mobilisatie worden beschreven in de “ICU Activity Codes and Definitions" (2012). In onderstaande tabel worden de activiteiten beschreven bij de verschillende vormen van mobilisatie bij IC-patiënten.
Tabel 11.1 De verschillende mobilisatie vormen bij IC-patiënten.
|
Vorm |
Definitie |
|
Mobiliseren in bed (zithouding) |
Verticalisatie in 70 tot 900 met bed in stoelhouding |
|
Mobiliseren op de rand van het bed |
Zitten op rand van bed (mag met ondersteuning) |
|
Mobiliseren in de stoel zonder te staan |
Transfer bed-stoel (zonder te staan) met behulp van tillift, slide of tillen |
|
Mobiliseren in stoel via stand met behulp van opstahulp
|
Transfer bed-stoel via stand (in staat om gewicht te dragen op beide benen) met behulp van opstahulp en ondersteuning van 1 tot 2 personen |
|
Mobiliseren in stoel via stand |
Transfer bed-stoel via stand (in staat om te stappen of te schuiven) al dan niet met gebruik van loophulpmiddel en ondersteuning van 1 tot 2 personen |
|
Lopen |
Lopen (minimaal 4 stappen; 2 met elke voet) al dan niet met loophulpmiddel en begeleiding |
Onder activatie verstaan we:
- Passieve fysiotherapeutische interventies:
- Passieve oefentherapie van de extremiteiten.
- Passief fietsen.
- Neuromusculaire elektrostimulatie (NMES).
- Actieve fysiotherapeutische interventies
- Actieve oefentherapie van de extremiteiten.
- Actief fietsen.
- Actieve ADL activiteiten in en rondom bed, zoals o.a.
- Gaan zitten.
- Staan.
- Lopen.
Onder revalidatie verstaan we “herstel na een ongeval of medische ziekte of ingreep”. Het revalidatieproces kan zowel meerdere lichamelijke als psychische aspecten omvatten.
De werkgroep definieerde de standaardgrens voor de dichotome uitkomstmaat mortaliteit van 3% als een klinisch (patiënt) relevant verschil (RR < 0,97 of > 1,03). Voor de uitkomstmaat bijwerkingen werd de incidentie van een bijwerking in meer dan 5% van de patiënten in de interventiegroep als klinisch relevant gedefinieerd. Voor verblijfsduur op de IC en duur van beademing werd 1 dag als klinisch relevant verschil gedefinieerd, voor ziekenhuisverblijfsduur 2 dagen. Voor continue uitkomstmaten werd een verschil van 10% als klinisch relevant gedefinieerd.
Zoeken en selecteren (Methode)
Omdat de werkgroep er rekening mee hield dat er nauwelijks literatuur beschikbaar zou zijn over het vroeg starten met mobilisatie of activatie bij sepsis, en een groot deel van de patiënten met sepsis wordt opgenomen en behandeld op een IC, hebben wij de literatuuranalyse uitgebreid naar de populatie ernstig zieke patiënten op de IC. In de databases Medline (via OVID) en Embase (via Embase.com) is op 2 augustus 2019 met relevante zoektermen gezocht naar relevante Engelstalige literatuur over vroege mobilisatie bij patiënten met sepsis of patiënten op de IC gepubliceerd vanaf 1989. De zoekverantwoording is weergegeven onder het tabblad Verantwoording. De literatuurzoekactie leverde 603 treffers op. Studies werden geselecteerd op grond van de volgende selectiecriteria: systematische reviews of vergelijkend (gerandomiseerd) onderzoek waarin de 1) vergelijking wordt gemaakt tussen het vroeg starten met mobilisatie van patiënten vergeleken met een late start of standaardzorg waarin de uitkomstmaten bijwerkingen of mortaliteit worden gerapporteerd; of 2) vergelijking wordt gemaakt tussen verschillende typen van vroege mobilisatie van patiënten waarin de uitkomstmaten functionaliteit/activiteit, verkorting IC/opnameduur, bijwerkingen, duur van beademing of spierkracht worden gerapporteerd. Bij beschikbaarheid van literatuur in een sepsispopulaitie, werden alleen deze artikelen geïncludeerd. Op basis van titel en abstract werden in eerste instantie 16 studies voorgeselecteerd. Na raadpleging van de volledige tekst, werden vervolgens 12 studies geëxcludeerd (zie exclusietabel onder het tabblad Verantwoording), en vier studies definitief geselecteerd.
Resultaten
. In totaal zijn vier RCT’s opgenomen in de literatuuranalyse. Deze beschreven interventies in een sepsispopulatie. Twee van deze RCT’s zijn opgenomen onder deelvraag 1: timing. Vanwege het ontbreken van studies die de vergelijking maakten tussen vroeg en laat starten met mobilisatie, werden alleen studies geïncludeerd die de vergelijking maakten tussen vroeg starten met mobilisatie versus standaardzorg. De twee overige RCT’s zijn opgenomen onder deelvraag 2: type interventie. De belangrijkste studiekarakteristieken en resultaten zijn opgenomen in de evidencetabellen. De beoordeling van de individuele studieopzet (risk of bias) is opgenomen in de risk of bias tabellen.
Referenties
- Ahn, J. Y., Song, J. E., Ann, H. W., Jeon, Y., Ahn, M. Y., Jung, I. Y., Kim, M. H., Jeong, W., Jeong, S. J., Ku, N. S., Kim, J. M., Na, S., Cho, S. R., & Choi, J. Y. (2018). Effects of Early Exercise Rehabilitation on Functional Recovery in Patients with Severe Sepsis. Yonsei medical journal, 59(7), 843–851. https://doi.org/10.3349/ymj.2018.59.7.843.
- Balady, G. J., Arena, R., Sietsema, K., Myers, J., Coke, L., Fletcher, G. F., Forman, D., Franklin, B., Guazzi, M., Gulati, M., Keteyian, S. J., Lavie, C. J., Macko, R., Mancini, D., Milani, R. V., American Heart Association Exercise, Cardiac Rehabilitation, and Prevention Committee of the Council on Clinical Cardiology, Council on Epidemiology and Prevention, Council on Peripheral Vascular Disease, & Interdisciplinary Council on Quality of Care and Outcomes Research (2010). Clinician's Guide to cardiopulmonary exercise testing in adults: a scientific statement from the American Heart Association. Circulation, 122(2), 191–225. https://doi.org/10.1161/CIR.0b013e3181e52e69.
- de Smet AM, Kluytmans JA, Cooper BS, et al. Decontamination of the digestive tract and oropharynx in ICU patients. N Engl J Med. 2009;360(1):20‐31. doi:10.1056/NEJMoa0800394.
- Callahan LA, Supinski GS. Sepsis-induced myopathy. Crit Care Med. 2009 Oct;37(10 Suppl):S354-67. doi: 10.1097/CCM.0b013e3181b6e439. PMID: 20046121; PMCID: PMC3967515.
- Capell, E. L., Tipping, C. J., & Hodgson, C. L. (2019). Barriers to implementing expert safety recommendations for early mobilisation in intensive care unit during mechanical ventilation: A prospective observational study. Australian critical care : official journal of the Confederation of Australian Critical Care Nurses, 32(3), 185–190. https://doi.org/10.1016/j.aucc.2018.05.005.
- Castro-Avila, A. C., Serón, P., Fan, E., Gaete, M., & Mickan, S. (2015). Effect of Early Rehabilitation during Intensive Care Unit Stay on Functional Status: Systematic Review and Meta-Analysis. PloS one, 10(7), e0130722. https://doi.org/10.1371/journal.pone.0130722.
- Corner, E. J., Murray, E. J., & Brett, S. J. (2019). Qualitative, grounded theory exploration of patients' experience of early mobilisation, rehabilitation and recovery after critical illness. BMJ open, 9(2), e026348. https://doi.org/10.1136/bmjopen-2018-026348.
- Dres M, Goligher EC, Heunks LMA, Brochard LJ. Critical illness-associated diaphragm weakness. Intensive Care Med. 2017 Oct;43(10):1441-1452. doi: 10.1007/s00134-017-4928-4. Epub 2017 Sep 15. PMID: 28917004.
- Eggmann, S., Verra, M. L., Luder, G., Takala, J., & Jakob, S. M. (2018). Effects of early, combined endurance and resistance training in mechanically ventilated, critically ill patients: A randomised controlled trial. PloS one, 13(11), e0207428. https://doi.org/10.1371/journal.pone.0207428.
- Friedrich O, Reid MB, Van den Berghe G, Vanhorebeek I, Hermans G, Rich MM, Larsson L. The Sick and the Weak: Neuropathies/Myopathies in the Critically Ill. Physiol Rev. 2015 Jul;95(3):1025-109. doi: 10.1152/physrev.00028.2014. PMID: 26133937; PMCID: PMC4491544.
- Haines, K. J., Berney, S., Warrillow, S., & Denehy, L. (2018). Long-term recovery following critical illness in an Australian cohort. Journal of intensive care, 6, 8. https://doi.org/10.1186/s40560-018-0276-x.
- Hickmann, C. E., Castanares-Zapatero, D., Deldicque, L., Van den Bergh, P., Caty, G., Robert, A., Roeseler, J., Francaux, M., & Laterre, P. F. (2018). Impact of Very Early Physical Therapy During Septic Shock on Skeletal Muscle: A Randomized Controlled Trial. Critical care medicine, 46(9), 1436–1443. https://doi.org/10.1097/CCM.0000000000003263.
- Hodgson, C. L., Iwashyna, T. J., & Schweickert, W. D. (2016). All That Work and No Gain: What Should We Do to Restore Physical Function in Our Survivors?. American journal of respiratory and critical care medicine, 193(10), 1071–1072. https://doi.org/10.1164/rccm.201512-2497ED.
- Hofhuis JG, Spronk PE, van Stel HF, Schrijvers AJ, Rommes JH, Bakker J. The impact of severe sepsis on health-related quality of life: a long-term follow-up study. Anesth Analg. 2008 Dec;107(6):1957-64. doi: 10.1213/ane.0b013e318187bbd8. PMID: 19020144.
- ICU Activity Codes and Definitions (2012). Available from: www.mobilization-network.org.
- Kayambu, G., Boots, R., & Paratz, J. (2015). Early physical rehabilitation in intensive care patients with sepsis syndromes: a pilot randomised controlled trial. Intensive care medicine, 41(5), 865–874. https://doi.org/10.1007/s00134-015-3763-8.
- Machado, A., Pires-Neto, R. C., Carvalho, M., Soares, J. C., Cardoso, D. M., & Albuquerque, I. M. (2017). Effects that passive cycling exercise have on muscle strength, duration of mechanical ventilation, and length of hospital stay in critically ill patients: a randomized clinical trial. Jornal brasileiro de pneumologia : publicacao oficial da Sociedade Brasileira de Pneumologia e Tisilogia, 43(2), 134–139. https://doi.org/10.1590/S1806-37562016000000170.
- Maheswaran, J., Fromowitz, J., & Goldfarb, M. (2020). Early Mobilization Interventions in the Intensive Care Unit: Ongoing and Unpublished Randomized Trials. Critical care research and practice, 2020, 3281394. https://doi.org/10.1155/2020/3281394.
- McWilliams, D., Jones, C., Atkins, G., Hodson, J., Whitehouse, T., Veenith, T., Reeves, E., Cooper, L., & Snelson, C. (2018). Earlier and enhanced rehabilitation of mechanically ventilated patients in critical care: A feasibility randomised controlled trial. Journal of critical care, 44, 407–412. https://doi.org/10.1016/j.jcrc.2018.01.001.
- Medrinal, C., Combret, Y., Prieur, G., Robledo Quesada, A., Bonnevie, T., Gravier, F. E., Dupuis Lozeron, E., Frenoy, E., Contal, O., & Lamia, B. (2018). Comparison of exercise intensity during four early rehabilitation techniques in sedated and ventilated patients in ICU: a randomised cross-over trial. Critical care (London, England), 22(1), 110. https://doi.org/10.1186/s13054-018-2030-0.
- Menges D, Seiler B, Tomonaga Y, Schwenkglenks M, Puhan MA, Yebyo HG. Systematic early versus late mobilization or standard early mobilization in mechanically ventilated adult ICU patients: systematic review and meta-analysis. Crit Care. 2021 Jan 6;25(1):16. doi: 10.1186/s13054-020-03446-9. PMID: 33407707; PMCID: PMC7789482.
- Needham, D. M., Korupolu, R., Zanni, J. M., Pradhan, P., Colantuoni, E., Palmer, J. B., Brower, R. G., & Fan, E. (2010). Early physical medicine and rehabilitation for patients with acute respiratory failure: a quality improvement project. Archives of physical medicine and rehabilitation, 91(4), 536–542. https://doi.org/10.1016/j.apmr.2010.01.002.
- Nydahl, P., Ruhl, A. P., Bartoszek, G., Dubb, R., Filipovic, S., Flohr, H. J., Kaltwasser, A., Mende, H., Rothaug, O., Schuchhardt, D., Schwabbauer, N., & Needham, D. M. (2014). Early mobilization of mechanically ventilated patients: a 1-day point-prevalence study in Germany. Critical care medicine, 42(5), 1178–1186. https://doi.org/10.1097/CCM.0000000000000149.
- Okada Y, Unoki T, Matsuishi Y, Egawa Y, Hayashida K, Inoue S. Early versus delayed mobilization for in-hospital mortality and health-related quality of life among critically ill patients: a systematic review and meta-analysis. J Intensive Care. 2019 Dec 9;7:57. doi: 10.1186/s40560-019-0413-1. PMID: 31867111; PMCID: PMC6902574.
- Parry, S. M., & Puthucheary, Z. A. (2015). The impact of extended bed rest on the musculoskeletal system in the critical care environment. Extreme physiology & medicine, 4, 16. https://doi.org/10.1186/s13728-015-0036-7.
- Puthucheary, Z. A., Astin, R., Mcphail, M., Saeed, S., Pasha, Y., Bear, D. E., Constantin, D., Velloso, C., Manning, S., Calvert, L., Singer, M., Batterham, R. L., Gomez-Romero, M., Holmes, E., Steiner, M. C., Atherton, P. J., Greenhaff, P., Edwards, L. M., Smith, K., Harridge, S. D., … Montgomery, H. E. (2018). Metabolic phenotype of skeletal muscle in early critical illness. Thorax, 73(10), 926–935. https://doi.org/10.1136/thoraxjnl-2017-211073.
- Puthucheary, Z. A., Rawal, J., McPhail, M., Connolly, B., Ratnayake, G., Chan, P., Hopkinson, N. S., Phadke, R., Dew, T., Sidhu, P. S., Velloso, C., Seymour, J., Agley, C. C., Selby, A., Limb, M., Edwards, L. M., Smith, K., Rowlerson, A., Rennie, M. J., Moxham, J., … Montgomery, H. E. (2013). Acute skeletal muscle wasting in critical illness. JAMA, 310(15), 1591–1600. https://doi.org/10.1001/jama.2013.278481.
- van der Schaaf, M., Dettling, D. S., Beelen, A., Lucas, C., Dongelmans, D. A., & Nollet, F. (2008). Poor functional status immediately after discharge from an intensive care unit. Disability and rehabilitation, 30(23), 1812–1818. https://doi.org/10.1080/09638280701673559.
- Shen, S. Y., Lee, C. H., Lin, R. L., & Cheng, K. H. (2017). Electric Muscle Stimulation for Weaning from Mechanical Ventilation in Elder Patients with Severe Sepsis and Acute Respiratory Failure–A Pilot Study. International Journal of Gerontology, 11(1), 41-45.
- Sommers, J., Engelbert, R. H., Dettling-Ihnenfeldt, D., Gosselink, R., Spronk, P. E., Nollet, F., & van der Schaaf, M. (2015). Physiotherapy in the intensive care unit: an evidence-based, expert driven, practical statement and rehabilitation recommendations. Clinical rehabilitation, 29(11), 1051–1063. https://doi.org/10.1177/0269215514567156.
- TEAM Study Investigators, Hodgson, C., Bellomo, R., Berney, S., Bailey, M., Buhr, H., Denehy, L., Harrold, M., Higgins, A., Presneill, J., Saxena, M., Skinner, E., Young, P., & Webb, S. (2015). Early mobilization and recovery in mechanically ventilated patients in the ICU: a bi-national, multi-centre, prospective cohort study. Critical care (London, England), 19(1), 81. https://doi.org/10.1186/s13054-015-0765-4.
- Tipping, C. J., Harrold, M., Holland, A., Romero, L., Nisbet, T., & Hodgson, C. L. (2017). The effects of active mobilisation and rehabilitation in ICU on mortality and function: a systematic review. Intensive care medicine, 43(2), 171–183. https://doi.org/10.1007/s00134-016-4612-0.
- van Beusekom, I., Bakhshi-Raiez, F., van der Schaaf, M., Busschers, W. B., de Keizer, N. F., & Dongelmans, D. A. (2019a). ICU Survivors Have a Substantial Higher Risk of Developing New Chronic Conditions Compared to a Population-Based Control Group. Critical care medicine, 47(3), 324–330. https://doi.org/10.1097/CCM.0000000000003576.
- van Beusekom, I., Bakhshi-Raiez, F., de Keizer, N. F., van der Schaaf, M., Termorshuizen, F., & Dongelmans, D. A. (2019b). Dutch ICU survivors have more consultations with general practitioners before and after ICU admission compared to a matched control group from the general population. PloS one, 14(5), e0217225. https://doi.org/10.1371/journal.pone.0217225.
- Wahab, R., Yip, N. H., Chandra, S., Nguyen, M., Pavlovich, K. H., Benson, T., Vilotijevic, D., Rodier, D. M., Patel, K. R., Rychcik, P., Perez-Mir, E., Boyle, S. M., Berlin, D., Needham, D. M., & Brodie, D. (2016). The implementation of an early rehabilitation program is associated with reduced length of stay: A multi-ICU study. Journal of the Intensive Care Society, 17(1), 2–11. https://doi.org/10.1177/1751143715605118.
- Wright, S. E., Thomas, K., Watson, G., Baker, C., Bryant, A., Chadwick, T. J., Shen, J., Wood, R., Wilkinson, J., Mansfield, L., Stafford, V., Wade, C., Furneval, J., Henderson, A., Hugill, K., Howard, P., Roy, A., Bonner, S., & Baudouin, S. (2018). Intensive versus standard physical rehabilitation therapy in the critically ill (EPICC): a multicentre, parallel-group, randomised controlled trial. Thorax, 73(3), 213–221. https://doi.org/10.1136/thoraxjnl-2016-209858.
Evidence tabellen
Evidence table for intervention studies (randomized controlled trials and non-randomized observational studies (cohort studies, case-control studies, case series))1
This table is also suitable for diagnostic studies (screening studies) that compare the effectiveness of two or more tests. This only applies if the test is included as part of a test-and-treat strategy - otherwise the evidence table for studies of diagnostic test accuracy should be used
Notes:
- Prognostic balance between treatment groups is usually guaranteed in randomized studies, but non-randomized (observational) studies require matching of patients between treatment groups (case-control studies) or multivariate adjustment for prognostic factors (confounders) (cohort studies); the evidence table should contain sufficient details on these procedures .
- Provide data per treatment group on the most important prognostic factors ((potential) confounders).
- For case-control studies, provide sufficient detail on the procedure used to match cases and controls.
- For cohort studies, provide sufficient detail on the (multivariate) analyses used to adjust for (potential) confounders.
Risk of bias table for intervention studies (randomized controlled trials)
|
Study reference
(first author, publication year) |
Describe method of randomisation1 |
Bias due to inadequate concealment of allocation?2
(unlikely/likely/unclear) |
Bias due to inadequate blinding of participants to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of care providers to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to inadequate blinding of outcome assessors to treatment allocation?3
(unlikely/likely/unclear) |
Bias due to selective outcome reporting on basis of the results?4
(unlikely/likely/unclear) |
Bias due to loss to follow-up?5
(unlikely/likely/unclear) |
Bias due to violation of intention to treat analysis?6
(unlikely/likely/unclear) |
|
Ahn, 2018 |
Computer-generated randomization was performed using concealed allocation (1:1 ratio). |
Unlikely |
Unlikely, participants could not be blinded for allocation as placebo was not possible.
However, hard outcome measures, so bias is unlikely. |
Unlikely, the researchers providing standard care were blinded. |
Unlikely, outcome assessors were blinded. |
Unlikely, the outcomes reported in the methods are reported in the results section. |
Likely, because of a small sample size. |
Unlikely, data analysed according to intention-to-treat principle. |
|
Kayambu, 2015 |
Enrolled participants were randomised into an intervention and standard care arm by computer generated randomisation http://www.randomization.com, using concealed allocation |
Unlikely. |
Unlikely, participants were blinded to group allocation. |
Unlikely, the researchers providing standard care were blinded. |
Unlikely, outcome assessors were blinded. |
Unlikely, the outcomes reported in the protocol are reported in the results section. |
Likely, because of a small sample size. |
Unlikely, data analysed according to intention-to-treat |
|
Hickmann, 2018 |
Not reported. |
Unknown |
Likely, participants could not be blinded for allocation as placebo was not possible. |
Likely, care provides were not blinded. |
Unlikely, blinded physician performed electrophysiologic tests, blinded physiotherapist measures muscle strength. |
Unlikely, the outcomes reported in the methods are reported in the results section. |
Likely, The first mobilization session was performed 46 ± 25 hours after ICU admission in the control group and 28 ± 9 hours in intervention group (p = 0.05). |
Unlikely, data analysed according to intention-to-treat principle. |
|
Shen, 2017 |
Not reported |
Unknown |
Likely, participants could not be blinded for allocation as placebo was not possible. |
Likely, care provides were not blinded. |
Likely, outcome assessors were not blinded. |
Unlikely, the outcomes reported in the methods section are reported in the results section. |
Likely, because of a small sample size. |
Unlikely, data analysed according to intention-to-treat principle. |
- Randomisation: generation of allocation sequences have to be unpredictable, for example computer generated random-numbers or drawing lots or envelopes. Examples of inadequate procedures are generation of allocation sequences by alternation, according to case record number, date of birth or date of admission.
- Allocation concealment: refers to the protection (blinding) of the randomisation process. Concealment of allocation sequences is adequate if patients and enrolling investigators cannot foresee assignment, for example central randomisation (performed at a site remote from trial location) or sequentially numbered, sealed, opaque envelopes. Inadequate procedures are all procedures based on inadequate randomisation procedures or open allocation schedules.
- Blinding: neither the patient nor the care provider (attending physician) knows which patient is getting the special treatment. Blinding is sometimes impossible, for example when comparing surgical with non-surgical treatments. The outcome assessor records the study results. Blinding of those assessing outcomes prevents that the knowledge of patient assignement influences the proces of outcome assessment (detection or information bias). If a study has hard (objective) outcome measures, like death, blinding of outcome assessment is not necessary. If a study has “soft” (subjective) outcome measures, like the assessment of an X-ray, blinding of outcome assessment is necessary.
- Results of all predefined outcome measures should be reported; if the protocol is available, then outcomes in the protocol and published report can be compared; if not, then outcomes listed in the methods section of an article can be compared with those whose results are reported.
- If the percentage of patients lost to follow-up is large, or differs between treatment groups, or the reasons for loss to follow-up differ between treatment groups, bias is likely. If the number of patients lost to follow-up, or the reasons why, are not reported, the risk of bias is unclear.
- Participants included in the analysis are exactly those who were randomized into the trial. If the numbers randomized into each intervention group are not clearly reported, the risk of bias is unclear; an ITT analysis implies that (a) participants are kept in the intervention groups to which they were randomized, regardless of the intervention they actually received, (b) outcome data are measured on all participants, and (c) all randomized participants are included in the analysis.
Exclusietabel
Tabel Exclusie na het lezen van het volledige artikel
|
Auteur en jaartal |
Redenen van exclusie |
|
Chao, 2014 |
Voldoet niet aan de PICO: training na ziekenhuisontslag |
|
Govindan, 2015 |
Geen systematic review |
|
Parry, 2012 |
Protocol voor een RCT |
|
Parry, 2014 |
Not randomised |
|
Symeonidou, 2019 |
Populatie voldoet niet aan PICO |
|
Segers, 2014 |
Populatie voldoet niet aan PICO (geen sepsis) |
|
Yang, 2016 |
Interventie (electro-acupunctuur) niet relevant voor Nederlandse zorg |
|
Stefanou, 2016 |
Geen uitkomstmaten uit PICO beschreven |
|
Schmidt, 2016 |
Interventie voldoet niet aan PICO |
|
Hickmann, 2014 |
Populatie voldoet niet aan PICO (geen sepsis) |
|
Poulsen, 2011 |
Geen uitkomstmaten uit PICO beschreven |
|
Wollersheim, 2019 |
Populatie voldoet niet aan PICO (geen sepsis) |
Verantwoording
Autorisatiedatum en geldigheid
Laatst beoordeeld : 01-09-2022
Laatst geautoriseerd : 05-10-2022
Geplande herbeoordeling :
Algemene gegevens
De ontwikkeling van deze richtlijnmodule werd ondersteund door het Kennisinstituut van de Federatie Medisch Specialisten (www.demedischspecialist.nl/kennisinstituut) en werd gefinancierd uit de Stichting Kwaliteitsgelden Medisch Specialisten (SKMS). De financier heeft geen enkele invloed gehad op de inhoud van de richtlijnmodule.
Samenstelling werkgroep
Voor het ontwikkelen van de richtlijnmodule is in 2017 een multidisciplinaire werkgroep ingesteld voor sepsis fase 1, de samenstelling van de werkgroep is gewijzigd in 2019 voor de ontwikkeling van sepsis fase II en III, bestaande uit vertegenwoordigers van alle relevante specialismen (zie hiervoor de Samenstelling van de werkgroep) die betrokken zijn bij de zorg voor patiënten met sepsis in het ziekenhuis.
Werkgroep
- Prof. Dr. A.R.H. van Zanten, internist-intensivist, Ziekenhuis Gelderse Vallei te Ede, NIV (voorzitter)
- Dr. C.H.S.B. van den Berg, intensivist-infectioloog, UMC Groningen, NVIC
- D. Bolman, patiëntvertegenwoordiger, IC Connect en FCIC
- V. Bon, verpleegkundig Specialist spoedeisende hulp, Onze Lieve Vrouwe Gasthuis, te Amsterdam en Ambulanceverpleegkundige bij Ambulance Amsterdam, V&VN-VS
- Dr. C.S.C. Bouman, internist-intensivist, Amsterdam UMC, locatie AMC, NIV
- Dr. L.P.G Derde, internist-intensivist, Universitair Medisch Centrum Utrecht te Utrecht, NVIC
- Drs. M. Hoogendoorn, manager Vakgroep Anesthesiologie & Intensive Care, Isala te Zwolle, V&VN-IC
- Dr. W.G. Ista, universitair hoofddocent Sector Verplegingswetenschap afdeling Interne Geneeskunde en universitair hoofddocent Kinder IC, Erasmus MC te Rotterdam, V&VN-IC
- Dr. R.W.M.M. Jansen, klinisch geriater, Noordwest ziekenhuisgroep te Alkmaar, NVKG
- Dr. H. P. Krepel, nefroloog, Bravis ziekenhuis te Roosendaal en Bergen op Zoom, NIV
- Dr. M.C.G. van de Poll, chirurg-intensivist, Maastricht UMC, NVIC
- Dr. B. P.C. Ramakers, internist-intensivist, RadboudUMC te Nijmegen, NVIC
- Dr. M.J.A. de Regt, internist-infectioloog/ internist-acute geneeskunde, Onze Lieve Vrouwe Gasthuis te Amsterdam, NIV
- Dr. S.U.C. Sankatsing, internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis te Utrecht, NIV
- Drs. R. Schellaars, intensivist, Ziekenhuis Gelderse Vallei te Ede, NVA
- Drs. R.M. Wilting, chirurg-intensivist, Elisabeth-TweeSteden ziekenhuis te Tilburg, NVvH
- Dr. J. Sommers, fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC, KNGF
Met ondersteuning van
- Dr. F. Willeboordse, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. R. Zwarts - van de Putte, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
- Dr. M.S. Ruiter, adviseur, Kennisinstituut van de Federatie Medisch Specialisten
Belangenverklaringen
De Code ter voorkoming van oneigenlijke beïnvloeding door belangenverstrengeling is gevolgd. Alle werkgroepleden hebben schriftelijk verklaard of zij in de laatste drie jaar directe financiële belangen (betrekking bij een commercieel bedrijf, persoonlijke financiële belangen, onderzoeksfinanciering) of indirecte belangen (persoonlijke relaties, reputatiemanagement) hebben gehad. Gedurende de ontwikkeling of herziening van een module worden wijzigingen in belangen aan de voorzitter doorgegeven. De belangenverklaring wordt opnieuw bevestigd tijdens de commentaarfase.
Een overzicht van de belangen van werkgroepleden en het oordeel over het omgaan met eventuele belangen vindt u in onderstaande tabel. De ondertekende belangenverklaringen zijn op te vragen bij het secretariaat van het Kennisinstituut van de Federatie Medisch Specialisten.
|
Werkgroeplid |
Functie |
Nevenfuncties |
Gemelde belangen |
Ondernomen actie |
|
A. van Zanten |
lnternist-intensivist, afdeling lntensive Care Ziekenhuis Gelderse Vallei, Ede Medisch Directeur, Ziekenhuis Gelderse Vallei, Ede |
Onbetaald: Voorzitter Sectie lC NIV Lid Concilium Interne Geneeskunde Lid GIC Lid platform kwaliteit NIV Lid ESPEN richtlijn commissie Voeding volwassen lC patiënten Lid diverse congrescommissies (Nationale Voedingscongres, internationaal Sepsis Symposium Netherlands, Mythen Missers en Maatwerk infectieuze bedreigingen, MasterclasslC Schiermonnikoog)
Betaald: Spreker voor voedingsfirma's (niet sepsis gerelateerd): Danone-Nutricia, Abbott, BBraun, Baxter, Fresenius-Kabi, Lyric,Mermaid, Nestle-Novartis.
initiator Masterclass Voeding en lC |
Participatie als onderzoeker in lC sepsis trials (b.v. KPA-ART 123 trombomoduline & adrenomedulline trial), opbrengsten vloeien naar Stichting lC research en worden niet uitgekeerd aan onderzoekers.
Echtgenote heeft een Congres- en Organisatiebureau interactie dat voor vele wetenschappelijke verenigingen congressen organiseert (onder andere sepsis congres).
|
Belangen zijn besproken, voorzitterschap is akkoord |
|
C. van den Berg |
intensivist-infectioloog, UMC Groningen |
Geen |
Geen |
Geen restricties |
|
D. Bolman |
vertegenwoordiger FCIC en IC Connect, ervaringsdeskundige |
vrijwilliger FCIC en IC Connect (onbetaald) vrijwilliger Nederlandse adoptievoorziening (onbetaald) |
Geen |
Geen restricties |
|
V. Bon |
Verpleegkundig Specialist SEH OLVG Ambulanceverpleegkundige bij Ambulance Amsterdam |
instructeur bij opleidingsinstituut spoedeisende geneeskunde in Houten (betaald). |
Ik heb meegewerkt aan de Phantasi trial, het prehospitaal toedienen van AB bij sepsis (https://classic.clinicaltrials.gov/ct2/show/NCT01988428). |
Geen restricties |
|
C. Bouman |
Internist-intensivist Care Volwassenen Amsterdam UMC locatie AMC |
Geen |
Geen |
Geen restricties |
|
L. Derde |
Intensivist UMC Utrecht (0,8 fte) Co-lead WP5 PREPARE (0,2 fte) |
EU coordinating investigator, voorzitter EU Regionale Management Commissie en lid Internationale Trial Stuur Commissie REMAP-CAP, onder andere gefinancierd via PREPARE (FP7) en RECOVER (H2020) grants
Lid NVVM influenza richtlijn
Lid ESICM (European Society of Intensive Care Medicine) commissie voor ernstige CAP (community acquired pneumonia)
Voorzitter van de Clinical Training Committee (CTC) van ESICM.
Lid SSC/ESICM/SCCM COVID-19 guideline committee
Voorzitter NVIC taskforce COVID-19 |
Betrokken bij onderzoek dat door EU wordt gefinancierd:
1. EU coordinating investigator REMAP-CAP: doel is zoeken naar optimale behandeling voor patiënten met community acquired pneumonie op de IC. REMAP-CAP wordt in andere regio's van de wereld ondersteund door andere funding (investigator driven). Diverse medicamenten (tocilizumab, sarilumab, interferon, lopinavir/ritonavir, anakinra) zijn (deels) door de fabrikanten geleverd voor de studie. In de Verenigde Staten wordt één van de domeinen (eritoran, apremilast) ondersteund door de fabrikanten (Eisai, Amgen). De funders, sponsors en fabrikanten hadden geen rol in de opzet van de studie, de analyses, publicaties, of beslissingen die in de trial zijn genomen. |
Geen restricties |
|
M. Hoogendoorn |
Vakgroep manager Anesthesiologie & Intensive Care, Isala, Zwolle |
Managing Director Athena Care B.V. - Research organisatie Vakgroep Anesthesiologie & Intensive Care (betaald) Bestuurslid V&VN-IC (onbetaald) Bestuurslid NICE (onbetaald)" |
Geen |
Geen restricties |
|
E. Ista |
Universitair docent/senior onderzoeker, IC Kinderen, Erasmus MC-Sophia Kinderziekenhuis, Rotterdam |
Universitair Hoofddocent/Senior onderzoeker, Verplegingswetenschap, Interne Geneeskunde, Erasmus MC, Rotterdam
Lid Bestuurscommissie Richtlijnen V&VN, Utrecht (onbetaald) tot 2018
Lid CCMO, discipline verplegingswetenschap (betaald) |
Geen |
Geen restricties |
|
R. Jansen |
Klinisch geriater, Noordwest ziekenhuisgroep, locatie Alkmaar |
Onderwijs aan Amstelacademie voor verschillende verpleegkundigen opleidingen (betaald).
Onbetaald medeorganisator ouderengeneeskunde congres Maastricht 2.0 in 2018, en 2019.
Onbetaald medeorganisator van nieuw congres Cardiovasculaire aandoeningen bij ouderen (CarVascGer) 2020 te Utrecht. |
Honoraria van Bayer Nederland, Boehringer-Ingelheim, Daiichi-Sankyo en BMS-Pfizer voor houden lezingen, webTV, et cetera over atriumfibrilleren en gebruik NOAC's en schrijven van bijdrage aan zakboekjes. |
Geen restricties |
|
H. Krepel |
Nefroloog, Bravis Ziekenhuis Roosendaal/Bergen op Zoom |
Geen |
Domestico studie (thuisdialyse) |
Geen actie |
|
M. van de Poll |
Intensivist MUMC+ |
Lid van richtlijncommissie NVIC Voeding |
Investigator-initiated grants van Fresenius Kabi en Nutricia, ZON-MW, KCE |
Restricties ten aanzien van het opstellen van aanbevelingen over voeding. |
|
B. Ramakers |
Intensivist in het Radboudumc |
Voorzitter stichting Venticare (kennisplatform voor medewerkers in de acute zorg): onbetaald |
Geen |
Geen restricties |
|
M. de Regt |
Internist Acute Geneeskunde/infectioloog Onze Lieve Vrouwe Gasthuis, Amsterdam |
Geen |
Geen |
Geen restricties |
|
S. Sankatsing |
Internist-infectioloog/ internist-acute geneeskunde, Diakonessenhuis Utrecht |
Bestuurslid Nederlandse Vereniging van lnternist-lnfectiologen (NVll), onbetaald
Lid Commissie Richtlijnen Nederlandse lnternisten Vereniging (NlV), waarvoor vacatiegelden
Lid Expertise team behandeling Covid-19 van de Federatie Medisch Specialisten (FMS), onbetaald |
Geen |
Geen restricties |
|
R. Schellaars |
Intensivist, Ziekenhuis Gelderse Vallei, Ede |
Voormalig bestuurslid SIC-NVA |
Geen |
Geen restricties |
|
R. Wilting |
Chirurg-intensivist, afdeling IC Elisabeth-TweeSteden ziekenhuis Tilburg |
Lid GIC (NVvH) |
Geen |
Geen restricties |
|
J. Sommers |
Fysiotherapeut en onderzoeker, Amsterdam UMC, locatie AMC |
Cursuscoördinator en docent NPI, scholing IC fysiotherapie (betaald) |
Geen |
Geen restricties |
|
M. Ruiter |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
R. Zwarts - van de Putte |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
|
F. Willeboordse |
Adviseur Kennisinstituut van de Federatie Medisch Specialisten |
Geen |
Geen |
Geen restricties |
Inbreng patiëntenperspectief
Er werd aandacht besteed aan het patiëntenperspectief door een patiëntenfocusgroep en afvaardiging van een patiëntvertegenwoordiger in de werkgroepen. Het verslag van de focusgroep (zie bijlage) is besproken in de werkgroep. De verkregen input is meegenomen bij het opstellen van de uitgangsvragen, de keuze voor de uitkomstmaten en bij het opstellen van de overwegingen. De conceptrichtlijn is voor commentaar voorgelegd aan Stichting Family and patient Centered Intensive Care (Stichting FCIC), aan IC Connect, de patiëntenorganisatie voor (voormalig) IC-patiënten en naasten en aan de Patiëntenfederatie Nederland en de eventueel aangeleverde commentaren zijn bekeken en verwerkt.
Patiëntenparticipatie bij deze richtlijn werd medegefinancierd uit de Kwaliteitsgelden Patiënten Consumenten (SKPC) binnen het programma KIDZ.
Methode ontwikkeling
Evidence based
Werkwijze
AGREE
Deze richtlijnmodule is opgesteld conform de eisen vermeld in het rapport Medisch Specialistische Richtlijnen 2.0 van de adviescommissie Richtlijnen van de Raad Kwaliteit. Dit rapport is gebaseerd op het AGREE II instrument (Appraisal of Guidelines for Research & Evaluation II; Brouwers, 2010).
Knelpuntenanalyse en uitgangsvragen
Tijdens de voorbereidende fase inventariseerde de werkgroep de knelpunten in de zorg voor patiënten met sepsis. Tevens zijn er knelpunten aangedragen door vertegenwoordigers van Ambulancezorg Nederland, Inspectie Gezondheidszorg en Jeugd, Nederlandse Internisten Vereniging, Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose, Nederlandse Vereniging voor Klinische Chemie en Laboratoriumgeneeskunde, Nederlandse Vereniging van Ziekenhuizen, Nederlandse Vereniging van Ziekenhuisapothekers, Family and Patient Centered Intensive Care en IC Connect, Stichting Werkgroep Antibiotica Beleid, Vereniging Innovatieve Geneesmiddelen en Dutch Acute Medicine via een Invitational conference. Een verslag hiervan is opgenomen onder aanverwante producten.
Op basis van de uitkomsten van de knelpuntenanalyse zijn door de werkgroep concept-uitgangsvragen opgesteld en definitief vastgesteld.
Uitkomstmaten
Na het opstellen van de zoekvraag behorende bij de uitgangsvraag inventariseerde de werkgroep welke uitkomstmaten voor de patiënt relevant zijn, waarbij zowel naar gewenste als ongewenste effecten werd gekeken. Hierbij werd een maximum van acht uitkomstmaten gehanteerd. De werkgroep waardeerde deze uitkomstmaten volgens hun relatieve belang bij de besluitvorming rondom aanbevelingen, als cruciaal (kritiek voor de besluitvorming), belangrijk (maar niet cruciaal) en onbelangrijk. Tevens definieerde de werkgroep tenminste voor de cruciale uitkomstmaten welke verschillen zij klinisch (patiënt) relevant vonden.
Methode literatuursamenvatting
Een uitgebreide beschrijving van de strategie voor zoeken en selecteren van literatuur en de beoordeling van de risk-of-bias van de individuele studies is te vinden onder ‘Zoeken en selecteren’ onder Onderbouwing. De beoordeling van de kracht van het wetenschappelijke bewijs wordt hieronder toegelicht.
Beoordelen van de kracht van het wetenschappelijke bewijs
De kracht van het wetenschappelijke bewijs werd bepaald volgens de GRADE-methode. GRADE staat voor ‘Grading Recommendations Assessment, Development and Evaluation’ (zie http://www.gradeworkinggroup.org/). De basisprincipes van de GRADE-methodiek zijn: het benoemen en prioriteren van de klinisch (patiënt) relevante uitkomstmaten, een systematische review per uitkomstmaat, en een beoordeling van de bewijskracht per uitkomstmaat op basis van de acht GRADE-domeinen (domeinen voor downgraden: risk of bias, inconsistentie, indirectheid, imprecisie, en publicatiebias; domeinen voor upgraden: dosis-effect relatie, groot effect, en residuele plausibele confounding).
GRADE onderscheidt vier gradaties voor de kwaliteit van het wetenschappelijk bewijs: hoog, redelijk, laag en zeer laag. Deze gradaties verwijzen naar de mate van zekerheid die er bestaat over de literatuurconclusie, in het bijzonder de mate van zekerheid dat de literatuurconclusie de aanbeveling adequaat ondersteunt (Schünemann, 2013; Hultcrantz, 2017).
|
Definitie |
|
|
Hoog |
|
|
Redelijk |
|
|
Laag |
|
|
Zeer laag |
|
Bij het beoordelen (graderen) van de kracht van het wetenschappelijk bewijs in richtlijnen volgens de GRADE-methodiek spelen grenzen voor klinische besluitvorming een belangrijke rol (Hultcrantz, 2017). Dit zijn de grenzen die bij overschrijding aanleiding zouden geven tot een aanpassing van de aanbeveling. Om de grenzen voor klinische besluitvorming te bepalen moeten alle relevante uitkomstmaten en overwegingen worden meegewogen. De grenzen voor klinische besluitvorming zijn daarmee niet één op één vergelijkbaar met het minimaal klinisch relevant verschil (Minimal Clinically Important Difference, MCID). Met name in situaties waarin een interventie geen belangrijke nadelen heeft en de kosten relatief laag zijn, kan de grens voor klinische besluitvorming met betrekking tot de effectiviteit van de interventie bij een lagere waarde (dichter bij het nuleffect) liggen dan de MCID (Hultcrantz, 2017).
Overwegingen (van bewijs naar aanbeveling)
Om te komen tot een aanbeveling zijn naast (de kwaliteit van) het wetenschappelijke bewijs ook andere aspecten belangrijk en worden meegewogen, zoals aanvullende argumenten uit bijvoorbeeld de biomechanica of fysiologie, waarden en voorkeuren van patiënten, kosten (middelenbeslag), aanvaardbaarheid, haalbaarheid en implementatie. Deze aspecten zijn systematisch vermeld en beoordeeld (gewogen) onder het kopje ‘Overwegingen’ en kunnen (mede) gebaseerd zijn op expert opinion. Hierbij is gebruik gemaakt van een gestructureerd format gebaseerd op het evidence-to-decision framework van de internationale GRADE Working Group (Alonso-Coello, 2016a; Alonso-Coello, 2016b). Dit evidence-to-decision framework is een integraal onderdeel van de GRADE-methodiek.
De aanbevelingen geven antwoord op de uitgangsvraag en zijn gebaseerd op het beschikbare wetenschappelijke bewijs en de belangrijkste overwegingen, en een weging van de gunstige en ongunstige effecten van de relevante interventies. De kracht van het wetenschappelijk bewijs en het gewicht dat door de werkgroep wordt toegekend aan de overwegingen, bepalen samen de sterkte van de aanbeveling. Conform de GRADE-methodiek sluit een lage bewijskracht van conclusies in de systematische literatuuranalyse een sterke aanbeveling niet a priori uit, en zijn bij een hoge bewijskracht ook zwakke aanbevelingen mogelijk (Agoritsas, 2017; Neumann, 2016). De sterkte van de aanbeveling wordt altijd bepaald door weging van alle relevante argumenten tezamen. De werkgroep heeft bij elke aanbeveling opgenomen hoe zij tot de richting en sterkte van de aanbeveling zijn gekomen.
In de GRADE-methodiek wordt onderscheid gemaakt tussen sterke en zwakke (of conditionele) aanbevelingen. De sterkte van een aanbeveling verwijst naar de mate van zekerheid dat de voordelen van de interventie opwegen tegen de nadelen (of vice versa), gezien over het hele spectrum van patiënten waarvoor de aanbeveling is bedoeld. De sterkte van een aanbeveling heeft duidelijke implicaties voor patiënten, behandelaars en beleidsmakers (zie onderstaande tabel). Een aanbeveling is geen dictaat, zelfs een sterke aanbeveling gebaseerd op bewijs van hoge kwaliteit (GRADE-gradering HOOG) zal niet altijd van toepassing zijn, onder alle mogelijke omstandigheden en voor elke individuele patiënt.
|
Implicaties van sterke en zwakke aanbevelingen voor verschillende richtlijngebruikers |
||
|
|
Sterke aanbeveling |
Zwakke (conditionele) aanbeveling |
|
Voor patiënten |
De meeste patiënten zouden de aanbevolen interventie of aanpak kiezen en slechts een klein aantal niet. |
Een aanzienlijk deel van de patiënten zouden de aanbevolen interventie of aanpak kiezen, maar veel patiënten ook niet. |
|
Voor behandelaars |
De meeste patiënten zouden de aanbevolen interventie of aanpak moeten ontvangen. |
Er zijn meerdere geschikte interventies of aanpakken. De patiënt moet worden ondersteund bij de keuze voor de interventie of aanpak die het beste aansluit bij zijn of haar waarden en voorkeuren. |
|
Voor beleidsmakers |
De aanbevolen interventie of aanpak kan worden gezien als standaardbeleid. |
Beleidsbepaling vereist uitvoerige discussie met betrokkenheid van veel stakeholders. Er is een grotere kans op lokale beleidsverschillen. |
Organisatie van zorg
In de knelpuntenanalyse en bij de ontwikkeling van de richtlijnmodule is expliciet aandacht geweest voor de organisatie van zorg: alle aspecten die randvoorwaardelijk zijn voor het verlenen van zorg (zoals coördinatie, communicatie, (financiële) middelen, mankracht en infrastructuur). Randvoorwaarden die relevant zijn voor het beantwoorden van deze specifieke uitgangsvraag zijn genoemd bij de overwegingen. Meer algemene, overkoepelende, of bijkomende aspecten van de organisatie van zorg worden behandeld in de module Organisatie van zorg.
Commentaar- en autorisatiefase
De conceptrichtlijnmodule werd aan de betrokken (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd ter commentaar. De commentaren werden verzameld en besproken met de werkgroep. Naar aanleiding van de commentaren werd de conceptrichtlijnmodule aangepast en definitief vastgesteld door de werkgroep. De definitieve richtlijnmodule werd aan de deelnemende (wetenschappelijke) verenigingen en (patiënt) organisaties voorgelegd voor autorisatie en door hen geautoriseerd dan wel geaccordeerd.
Kwalitatieve raming van mogelijke financiële gevolgen in het kader van de Wkkgz
Bij fase II/III van de richtlijn is conform de Wet kwaliteit, klachten en geschillen zorg (Wkkgz) een kwalitatieve raming uitgevoerd of de aanbevelingen mogelijk leiden tot substantiële financiële gevolgen. Bij het uitvoeren van deze beoordeling zijn richtlijnmodules op verschillende domeinen getoetst. Uit de kwalitatieve raming blijkt dat er geen substantiële financiële gevolgen zijn, zie onderstaande tabel.
|
Module |
Uitkomst kwalitatieve raming |
Toelichting |
|
Vasopressoren |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Inotropica |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: modaliteit |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: timing |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: dosering |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Nierfunctievervangende therapie: antistolling |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatiemiddel |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Sedatie: continu vs. interruptie |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Niet-medicamenteuze behandeling van delier |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Transfusiebeleid |
n.v.t. |
Verwijzing naar bestaande module. |
|
Mobilisatie |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Voeding |
geen substantiële financiële gevolgen |
Uit de toetsing volgt dat de aanbevelingen niet breed toepasbaar zijn (<5.000 patiënten) en zullen daarom naar verwachting geen substantiële financiële gevolgen hebben voor de collectieve uitgaven. |
|
Voorlichting langetermijngevolgen |
geen substantiële financiële gevolgen |
Hoewel uit de toetsing volgt dat de aanbevelingen breed toepasbaar zijn (5.000-40.000 patiënten), volgt ook uit de toetsing dat het geen nieuwe manier van zorgverlening of andere organisatie van zorgverlening betreft. Er worden daarom geen substantiële financiële gevolgen verwacht. |
|
Randvoorwaarden |
geen substantiële financiële gevolgen |
In deze module wordt vooral verwezen naar andere relevante documenten verwezen. Er worden daarom geen financiële gevolgen verwacht. |
Literatuur
Agoritsas T, Merglen A, Heen AF, Kristiansen A, Neumann I, Brito JP, Brignardello-Petersen R, Alexander PE, Rind DM, Vandvik PO, Guyatt GH. UpToDate adherence to GRADE criteria for strong recommendations: an analytical survey. BMJ Open. 2017 Nov 16;7(11):e018593. doi: 10.1136/bmjopen-2017-018593. PubMed PMID: 29150475; PubMed Central PMCID: PMC5701989.
Alonso-Coello P, Schünemann HJ, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Rada G, Rosenbaum S, Morelli A, Guyatt GH, Oxman AD; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ. 2016 Jun 28;353:i2016. doi: 10.1136/bmj.i2016. PubMed PMID: 27353417.
Alonso-Coello P, Oxman AD, Moberg J, Brignardello-Petersen R, Akl EA, Davoli M, Treweek S, Mustafa RA, Vandvik PO, Meerpohl J, Guyatt GH, Schünemann HJ; GRADE Working Group. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ. 2016 Jun 30;353:i2089. doi: 10.1136/bmj.i2089. PubMed PMID: 27365494.
Brouwers MC, Kho ME, Browman GP, Burgers JS, Cluzeau F, Feder G, Fervers B, Graham ID, Grimshaw J, Hanna SE, Littlejohns P, Makarski J, Zitzelsberger L; AGREE Next Steps Consortium. AGREE II: advancing guideline development, reporting and evaluation in health care. CMAJ. 2010 Dec 14;182(18):E839-42. doi: 10.1503/cmaj.090449. Epub 2010 Jul 5. Review. PubMed PMID: 20603348; PubMed Central PMCID: PMC3001530.
Hultcrantz M, Rind D, Akl EA, Treweek S, Mustafa RA, Iorio A, Alper BS, Meerpohl JJ, Murad MH, Ansari MT, Katikireddi SV, Östlund P, Tranæus S, Christensen R, Gartlehner G, Brozek J, Izcovich A, Schünemann H, Guyatt G. The GRADE Working Group clarifies the construct of certainty of evidence. J Clin Epidemiol. 2017 Jul;87:4-13. doi: 10.1016/j.jclinepi.2017.05.006. Epub 2017 May 18. PubMed PMID: 28529184; PubMed Central PMCID: PMC6542664.
Medisch Specialistische Richtlijnen 2.0 (2012). Adviescommissie Richtlijnen van de Raad Kwalitieit. http://richtlijnendatabase.nl/over_deze_site/over_richtlijnontwikkeling.html.
Neumann I, Santesso N, Akl EA, Rind DM, Vandvik PO, Alonso-Coello P, Agoritsas T, Mustafa RA, Alexander PE, Schünemann H, Guyatt GH. A guide for health professionals to interpret and use recommendations in guidelines developed with the GRADE approach. J Clin Epidemiol. 2016 Apr;72:45-55. doi: 10.1016/j.jclinepi.2015.11.017. Epub 2016 Jan 6. Review. PubMed PMID: 26772609.
Schünemann H, Brożek J, Guyatt G, et al. GRADE handbook for grading quality of evidence and strength of recommendations. Updated October 2013. The GRADE Working Group, 2013. Available from http://gdt.guidelinedevelopment.org/central_prod/_design/client/handbook/handbo.
Zoekverantwoording
Zoekacties zijn opvraagbaar. Neem hiervoor contact op met de Richtlijnendatabase.
